| |
Аутоиммунный бунт конца жизни
Страдания при аутоиммунных заболеваниях усугубляются досадой: ведь их причиняет та самая функция организма, которая призвана его защищать. Иммунная система даёт сбой и начинает убивать клетки самого организма. Сидром Съегрена — патология желез, вызванная аутоиммунными нарушениями. Характерные признаки этого нарушения — сухость глаз, носа, гортани и других слизистых оболочек.
Более столетия назад выдающийся российский ученый Илья Мечников (1845–1916) сделал удивительное открытие макрофага — клетки, которая пожирает «мусор» в нашем организме. Мечников открыл клетку мощной и весьма разноликой системы — иммунитета. Сегодня изучены и другие клетки иммунной системы — Т-лимфоциты, В-клетки.
Стражи иммунной системы постоянно «прощупывают» весь организм на предмет чужеродных клеток. Когда Т-лимфоциты по наводке макрофагов распознают антигены бактерий, вирусов или дефектную клетку организма, они подают сигналы о «нашествии врагов» другим клеткам, которые их и уничтожают. Помимо внедрившихся паразитов, клетки иммунной системы постоянно сталкиваются ещё и с клетками собственного организма, и разрушительные иммунные реакции не должны их касаться. Способность отличать «чужое» от «своего» — важнейшее свойство иммунной системы.
Однако известно много случаев сбоя в работе иммунитета, когда клетки иммунной системы принимают клетки своего организма за чужие и атакуют их — подобно мятежным войскам, направляют свой удар на тех, кого они призваны защищать.
Аутоиммунные заболевания — это серьёзная медицинская проблема современного человечества. В настоящее время иммунологам известно более восьмидесяти разновидностей подобных расстройств, многие из них приводят к тяжелым страданиям, ограничению физических возможностей и даже смертельному исходу. Аллергия, рассеянный склероз, красная волчанка, диабет I типа, ревматоидный артрит — все эти и многие другие расстройства связаны со сбоем в работе иммунитета.
Предъявите паспорт!
В период внутриутробного развития или сразу после рождения иммунная система человека проходит специальную подготовку, чтобы не реагировать на собственные молекулы — затесавшиеся среди миллиардов лимфоцитов несколько «изменников», нападающих на своего хозяина, либо уничтожаются, либо выводятся из игры. В большинстве случаев этого оказывается достаточно для «подавления восстания». Но время от времени одна из клеток-предателей ускользает от досмотра. Каждый из нас имеет в крови некоторое количество таких аутоиммунных клеток, однако «за оружие» они почти никогда не берутся.
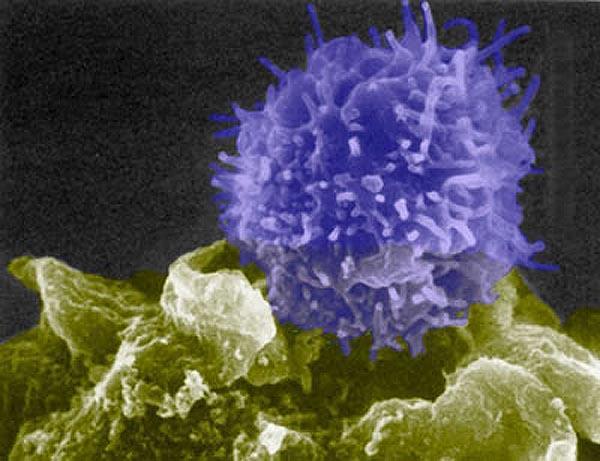
Т-лимфоцит (синий) проверяет клетку (зелёную) на предмет чужеродности. Если клетка не прошла контроль, Т-лимфоцит тут же даст команду другим клеткам уничтожить её. Фото: Berkeley Lab
Почему иммунные лимфоциты вдруг начинают атаковать клетки собственного организма, разобраться не так-то просто. Чтобы бороться с «чужаками», клеткам иммунной системы необходимо сначала распознать их. В этом им помогают специальные белки, расположенные на поверхности клеток и «представляющие» антигены, — МНС. Именно они сигнализируют иммунным «стражам», что клетки «свои». Процесс распознавания осуществляется с помощью мощных протеиновых рецепторов-«щупов», расположенных на поверхности Т-хелперов (клеток иммунной системы). Если «паспорт» проверяемой клетки нормальный, то её оставляют в покое. Но ведь это могут быть и антигены «чужака» — например гриппозные, раковые, паразитарные клетки. В этих случаях клетка иммунного ответа поднимает тревогу и насылает на врага «киллеров».
Войско мятежников
Сложность в том, что из-за мутаций «чужые» антигены могут появляться на поверхности здоровой клетки. Например, «точечные» мутации — самые простые — проявляются в замене одной буквы ген-кода, что ведёт к замене аминокислоты в белковой цепи. Мутации могут иметь разную степень выраженности и последствия; бывают, например, «нейтральные» замены, которые вообще никак не сказываются на клетках.
Более того, мутации могут наблюдаться и в клетках самой иммунной системы. Аутоиммунные (бракованные) лимфоциты могут каким-то образом «ускользать» из лимфатических узлов и тимуса — главного органа иммунной системы. В общем, когда речь заходит о мутациях, приводящих к возникновению аутоиммунных реакций, их природа, механизм возникновения и количество могут быть самыми разными.
Классический пример аутоиммунного расстройства — диабет I типа, при котором Т-лимфоциты атакуют островки Лангерганса в поджелудочной железе, клетки которых синтезируют гормон инсулин. Мутации в одном из генов островковых клеток приводят к тому, что на их поверхности появляется «чужеродный» белок, стражи иммунной системы распознают этот белок и начинают бороться с клеткой как с врагом. В поджелудочной железе развивается Т-клеточное воспаление, в результате чего аутоиммунные лимфоциты убивают синтезирующие инсулин клетки, и организм начинает страдать от недостатка инсулина. У диабета II типа совсем иная генетическая природа — производство инсулина не падает, просто гормон не действует на клетки.
Вполне возможно, что аутоиммунные процессы оказывают и более глобальное воздействие на наш организм. Речь идёт о не столь уж приятном, но биологически закономерном старении клеток и организма в целом.
Старение — аутоиммунная «болезнь»?
В разные времена существовало множество воззрений на старение. Альфред Уоллес (Alfred Russel Wallace, 1823–1913), провозглашаемый «сподвижником» Чарльза Дарвина (Charles Robert Darwin, 1809–1882), полагал, что старость человека запрограммирована, чтобы избежать конкуренции с потомками. Его идею развили генетики, которые в 1920-х годах говорили, что программа старения записана в генетическом коде человека, но никаких убедительных доказательств своей гипотезы они предложить не могли. Лишь иммунолог Питер Медавар (Peter Brian Medawar, 1915–1987), будущий нобелевский лауреат 1960 года, в конце 1940-х сформулировал идею, которую можно было проверить: старение вызывают накапливаемые мутации, «засоряющие» клетки и организм, в котором не предусмотрено механизма очистки.
Механизмы старения, поиск связи процессов старения и работы иммунной системы организма волнуют учёные умы многие десятилетия. К сожалению, мимо внимания большой науки прошло открытие Клайва Маккея (Clive McCay), работавшего в Корнеллском университете (Cornell University). А Маккей ещё в 1930 году в экспериментах на крысах доказал, что сокращение числа калорий на треть на ту же величину продлевает их жизнь! Это удивительное явление получило название «калорическая рестрикция», то есть «урезание калорий».
Значительно большее внимание ученых привлекло сообщение Денхама Хармана (Denham Harman), профессора университета Небраски, опубликованное в 1956 году в «Геронтологическом журнале» (Journal of Gerontology). Согласно свободнорадикальной теории (Free Radical Theory of Aging) Хармана, в процессе жизнедеятельности в нашем организме образуются агрессивные формы кислорода — свободные радикалы, или оксиданты. Они легко вступают в реакции, разрушая молекулы, клетки, и вызывают клеточные мутации.
Изучение маленького почвенного червячка Саеnorabditis elegans, у которого всего лишь тысяча клеток и геном которого геном давно прочитан, позволило выделить и изучить гены старения. Пятнадцать лет назад Синтия Кеньон (Cynthia Kenyon) из Калифорнийского университета в Сан-Франциско (University of California at San Francisco) открыла у червячка ген, мутация которого на фоне голодания увеличивала его жизнь на две трети. Когда же ученые «отключили» ещё и второй ген, отвечающий за образование половых клеток, то продолжительность жизни червяка увеличилась до фантастических пятисот лет (в пересчёте на годы жизни человека).
Нормальная клетка в здоровом организме постоянно находится перед дилеммой: либо выполнять очередное деления, либо перейти к апоптозу — генетически запрограммированной смерти, защищающей весь процесс деления от сбоев. Важным открытием начала геномного миллениума было выделение и характеристика раковых стволовых клеток. В опытах на мышах с иммунодефицитом, то есть с отключенной реакцией отторжения, эти клетки были готовы в любой момент воспроизвести опухоль, не поддающуюся ни облучению, ни химиотерапии. Ученые выяснили, что устойчивость опухолевых клеток к внешним воздействиям связана с резким усилением функции ферментов «починки» (репарации) ДНК, вещества наших генов. Известно также, что в раковых клетках необычайно активен и фермент теломераза. Его функция заключается в удлинении ДНК на концах хромосом, называемых теломерами. Несмотря на теломеры длина нормальной ДНК с каждым новым делением клетки уменьшается, и когда она достигает минимального предела, клетка должна погибнуть. В раковых клетках из-за активной работы фермента теломеразы уменьшения длины ДНК нет, поэтому они безостановочно делятся.
Второе большое открытие связано с тем, что клетки от перерождения их в раковые защищает процесс старения — постепенно в клетках «выключается» один протеиновый каскад за другим, что способствует, например, снижению тех же энергетических потребностей человека (хотя субъективно это воспринимается как повышенная утомляемость и снижение работоспособности). Параллельно этому процессу угасает и «резкость» иммунного ответа: если в 16 лет тимус человека производит Т-лимфоциты, способные реагировать примерно на 100 млн антигенов, то в 60 лет — всего лишь на 2 млн. Это уменьшение отражает не только естественное старение иммунной системы, но и «сдерживание» аутоиммунных реакций, не сулящих в пожилом возрасте ничего хорошего — ведь клетки накапливают в своем геноме все больше и больше «ошибок».
Перечисленные результаты исследований позволяют нарисовать общую картину: потребление пищи приводит к росту концентрации свободных радикалов, «рвущих» ДНК, что требует обязательного восстановления её целостности с помощью ферментов «починки». Однако копирование ДНК неизбежно приводит к ошибкам-мутациям, постепенно — по Медавару — «засоряющим» наш геном. Каждая клетка тела находится под неусыпным иммунным надзором. Надзор осуществляется клетками, геном которых тоже претерпевает возрастные изменения, то есть в них самих происходит «засорение» генов мутациями. Именно поэтому с возрастом реакция клеток иммунитета меняется.
Прогерия (преждевременное старение), вызываемая мутацией в гене ламина, доказывает тот факт, что чрезмерная активация генов может приводить к «сгоранию» практически всех стволовых клеток ещё в первые годы жизни ребенка. Без активности стволовых клеток невозможно поддержание иммунного ответа, роста волос и ногтей, кожи и «смены» слизистой. Если стволовые клетки не могут обеспечить «самообновления» тканей и органов, развиваются болезни. В то же время небольшие количества белка прогерина в клетках способствуют их нормальному старению у людей пожилого возраста.
Включение аутоиммунного ответа лимфоцитов может являться естественным молекулярным механизмом нормального старения, проявляющегося у разных людей с той или иной скоростью, в результате чего одни живут до восьмидесяти лет, а некоторые и до ста двадцати.
Сегодня врачи уже имеют в своем распоряжении целый набор иммуномодуляторов и даже иммунодепрессантов, которые подавляют чересчур активные клетки иммунной системы. Но их применение пока оправдано лишь при трансплантации органов и тканей, поскольку они уж слишком рьяно «давят» иммунную реакцию. Механизм действия этих веществ заключается в блокировании протеинов иммунных лимфоцитов. А нужны такие иммуноактивные «субстанции», которые, проникая в ядра этих клеток, мягко регулировали бы активность нужных генов-мишеней.
Вероятно, время, когда в распоряжении врачей появятся подобные «мягкие» активаторы или блокаторы, не за горами. И тогда можно будет говорить о реальной приостановке процессов старения и эффективном продлении активной жизни без болезней и сопровождающего старость ухудшения качества жизни.
Игорь Лалаянц, 24.04.2008
|